- Pracowałem z najlepszymi. Możesz mi zaufać.
- 790-768-482
- info@rafalszrajnert.pl
Dobra praktyka laboratoryjna (GLP) (DPL) Przeprowadzanie badań zgodnie z zasadami dobrej praktyki

Spójność pomiarowa – wzorcowanie – metrologia -czym są? (przykłady, definicja)
16 grudnia, 2022
Negocjacje w biznesie – co to? Definicja, przykłady, rodzaje, etapy, zasady
16 grudnia, 2022Dobra praktyka laboratoryjna (GLP) (DPL) Przeprowadzanie badań zgodnie z zasadami dobrej praktyki


Czym jest Dobra Praktyka Laboratoryjna? Co to znaczy GPL? Definicja.
Zawartość strony
- 1 Czym jest Dobra Praktyka Laboratoryjna? Co to znaczy GPL? Definicja.
- 2 Dołącz do nas NA DARMOWYM WIDEO
- 3 Główne cele Dobrej Praktyki Laboratoryjnej:
- 4 Zadania GLP
- 5 Zasady „dobrej praktyki laboratoryjnej”: obszary i regulacje personalne
- 6 Dobra Praktyka Laboratoryjna DPL zasady (struktura załącznika nr 1)
- 7 Przeprowadzenie badania i zawartość planu badania
- 8 Sprawozdanie z badań
- 9 ARCHIWIZACJA I PRZECHOWYWANIE ZAPISÓW I MATERIAŁÓW
- 10 Kontrola zgodna z GLP i zezwolenie
- 11 Walidacja urządzeń
- 12 Kontrola DPL, na co zwracać uwagę?
- 13 Najważniejsze dokumenty regulujące stosowanie zasad Dobrej Praktyki Laboratoryjnej DPL:
- 14 Dobra praktyka laboratoryjna (GLP) (DPL) Przeprowadzanie badań zgodnie z zasadami dobrej praktyki
Dobra Praktyka Laboratoryjna (z ang. Good Laboratory Practice, GLP) to system zarządzania i nadzoru nad badaniami przeprowadzanymi w laboratoriach, zgodny z zasadami określonymi w rozporządzeniach i wytycznych Unii Europejskiej. GLP zapewnia, że badania laboratoryjne są przeprowadzane zgodnie z zaleceniami i że wyniki są dokładne i wiarygodne. GLP umożliwia również porównywalność wyników, co ułatwia wnioskowanie i wyciąganie wniosków na temat skuteczności produktu.
„Dobra praktyka laboratoryjna (skrót. DPL, z angielskiego GLP – good laboratory practises) – system zapewnienia jakości badań. Regulujący tematykę zapewnienia jakości podczas badania i opracowywania leków. „
Zaufali mi najlepsi:

Dołącz do nas NA DARMOWYM WIDEO
Wpisz Swój Najlepszy Adres Email, Ponieważ Na Niego Dostaniesz Link.
Dotyczy zasad organizacji jednostek badawczych wykonujących niekliniczne badania z zakresu zdrowia człowieka/środowiska, bezpieczeństwa produktów leczniczych, weterynaryjnych produktów leczniczych, środków ochrony roślin, kosmetyków, produktów biobójczych, dodatków do żywności, dodatków do pasz, detergentów, genetycznie zmodyfikowanej żywności i paszy oraz chemikaliów stosowanych w przemyśle, usługach i gospodarstwie domowym.
Badania, do których stosuje się zasady DPL, obejmują badania w laboratoriach, badania w szklarniach i badania polowe. Szczególnie podczas badania substancji i preparatów chemicznych. GLP ma zapobiegać skandalom i naruszeniom w przemyśle farmaceutycznym.

Została ona wprowadzona globalnie, a opisane w niej zasady są dzięki temu respektowane i uznawane na całym świecie.
W Polsce zasady GLP, wprowadzono dnia 10 czerwca 2013 r. poprzez Rozporządzenie Ministra Zdrowia z dnia 22 maja 2013r. w sprawie Dobrej Praktyki Laboratoryjnej i wykonywania badań zgodnie z zasadami Dobrej Praktyki Laboratoryjnej.
Rozporządzenie określa:
- zasady DPL
- sposób dokonywania kontroli i weryfikacji
- procedurę uzyskiwania i cofania certyfikatu
Jasno formułuje zasady organizacji jednostek badawczych wykonujących niekliniczne badania z zakresu środowiska i bezpieczeństwa i zdrowia człowieka, skupiając się również na badaniu preparatów i substancji chemicznych wymagane ustawą, oraz warunki, w jakich te badania są przeprowadzane, monitorowane i planowane.
Czyli forma wyników jak ich zapisywane, przechowywane i podawanie w sprawozdaniu.
REKLAMA
Koniecznie zobacz NAJLEPSZE szkolenie z Facebooka na rynku

Link do kursu: szkolenie Facebook Ads
Koniec reklamy.
Celem zasad dobrej praktyki laboratoryjnej jest promowanie jakości i wiarygodności uzyskiwanych wyników badań, od momentu ich planowania aż po właściwe przechowywanie danych źródłowych i sprawozdań, tak by możliwe było prześledzenie toku badania lub jego całkowite odtworzenie.
Główne cele Dobrej Praktyki Laboratoryjnej:
- Testowanie, systemów badawczych i ich powtarzalności. Badania prowadzone nad substancjami i preparatami chemicznymi są porównywalne;
- SOP, standard operating procedures;
- Zaufanie do wyników badań innych placówek i innych państw. Unikanie powielania tych samych badań, co obniża koszty oraz czas realizacji zadań;
- Przeciwdziałanie powstawaniu barier technicznych w zakresie handlu;
- Ochrona zdrowia człowieka i środowiska;
- Organizacja personelu i zarządzanie badaniami;
- Raportowanie uzyskanych wyników;
- Dostęp do wymaganych urządzeń i metodyki;
- Klarowność przedstawiania założeń badania i protokół
- Program zapewnienia jakości, poprawa jakości wykonywanych badań, eliminacja lub maksymalne ograniczenie popełniania błędów;
- Możliwość kontroli wykonywanych prac badawczych na każdym etapie.
- Archiwizowanie danych (każdy typ)
Zadania GLP
System DPL ma zapewnić, że otrzymane i przesłane dalej dane są prawdziwym odzwierciedleniem wyników uzyskanych podczas badań
System DPL ma zapewnić, że przedstawiane dane są weryfikowalne, czyli można dokładnie powtórzyć badanie
System DPL ma promować międzynarodowe akceptowanie uzyskiwanych wyników
Zasady „dobrej praktyki laboratoryjnej”: obszary i regulacje personalne
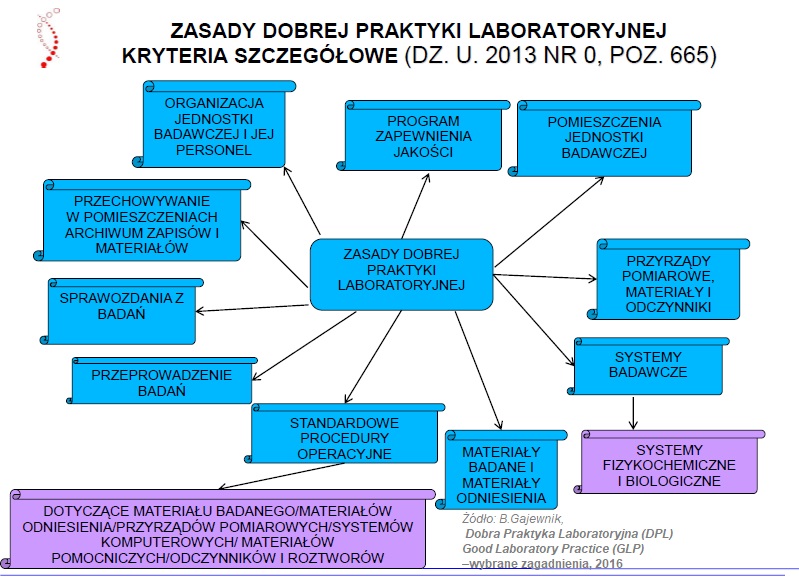
Dobra Praktyka Laboratoryjna DPL zasady (struktura załącznika nr 1)
- Terminologia DPL
- Organizacja jednostki badawczej i jej personel
- Program zapewnienia jakości
- Jednostka badawcza
- Przyrządy pomiarowe, materiały i odczynniki
- Systemy badawcze
- Materiały badane i materiały odniesienia
- Standardowe procedury operacyjne
- Przeprowadzenie badania
- Sprawozdania zbadań
- Przechowywanie w pomieszczeniu archiwum zapisów i materiałów
Organizacja jednostki badawczej i jej personel
Dobra Praktyka Laboratoryjna obejmuje wymagania dla laboratoriów dotyczące personelu, aparatury, metod badawczych i zapisów, oraz zakresy odpowiedzialności podczas kontroli. Ogólne wymagania GLP Dobrej Praktyki Laboratoryjnej dla laboratorium badawczego obejmują:
- Odpowiednio wyszkolony personel.
- Standardowe metody analityczne/ Standardowe procedury operacyjne.
- Plan częstotliwości pobierania badania prób, sposób ich pobierania.
- Właściwa aparatura- wyposażenie badawczo-pomiarowe (regularnie sprawdzanie i kalibrowanie, wzorcowanie).
- Przechowywanie wyników badań- archiwizacja (w tym osoba wyznaczona do jego prowadzenia).
- System zapisów.
- W jednostce badawczej został przyjęty program zapewnienia jakości.
- Dla każdego pracownika, także personelu technicznego, są na bieżąco prowadzone i uaktualniane zapisy dotyczące jego kwalifikacji, szkoleń, zdobytego doświadczenia i rodzaju wykonywanych prac.
- Przed wykonaniem jakiegokolwiek badania jest wyznaczona osoba o odpowiednich kwalifikacjach, przeszkoleniu i doświadczeniu, pełniąca obowiązki kierownika badania.
- W przypadku wykonywania badań w wielu miejscach, jeżeli istnieje taka potrzeba, jest wyznaczony główny wykonawca posiadający odpowiednie kwalifikacje.
- Plan badania i wszystkie jego poprawki są zatwierdzane w odpowiedni sposób przez kierownika badania, który udostępnia zatwierdzony plan badania osobie lub osobom prowadzącym program zapewnienia jakości.
- Wyposażenie, sprzęt i materiały dostarczane do jednostki badawczej spełniają wymagania niezbędne do ich zastosowania w wykonywanych badaniach.
- Materiał badany i materiał odniesienia są właściwie scharakteryzowane.
- Istnieją procedury gwarantujące, że stosowane systemy komputerowe są odpowiednie do celów, do których będą wykorzystywane, oraz że są one zwalidowane oraz stosowane i utrzymywane zgodnie z zasadami DPL.
Kierownik badania zgodnie z DPL:
- ponosi odpowiedzialność za właściwe kierowanie całością badania, za jego przeprowadzenie i sporządzenie sprawozdania końcowego z badań
- akceptuje plan badania i wszystkie jego poprawki
- zapewnia przekazanie odpowiednio wcześnie kopii planu badania i wszystkich jego poprawek osobie lub osobom prowadzącym program zapewnienia jakości
- zapewnia udostępnienie planu badania i jego poprawek oraz standardowych procedur operacyjnych personelowi wykonującemu badanie
- zapewnia, że w przypadku badań wykonywanych w wielu miejscach plan badania i sprawozdanie końcowe precyzyjnie określają zadania i miejsca
- gwarantuje, że wszystkie procedury przewidziane w planie badania są przestrzegane, oraz ocenia i dokumentuje wpływ odstępstw
- gwarantuje, że wszystkie dane źródłowe (np. oryginalne zapisy, zweryfikowane kopie, wyniki pomiarów, fotografie, mikrofilmy, kopie mikrofiszek, rejestracje komputerowe lub zapisy dokonane za pomocą dyktafonu, dane z urządzeń zautomatyzowanych,a także zapisy na wszelkich nośnikach danych ) są udokumentowane i zapisane
- gwarantuje, że systemy komputerowe stosowane w badaniach zostały zwalidowane
- podpisuje i opatruje datą sprawozdanie końcowe, aby wskazać przyjęcie odpowiedzialności za wiarygodność danych i wskazać zakres(stopień),w jakim badanie spełnia zasady DPL
- gwarantuje, że po zakończeniu badania plan badania, dane źródłowe, sprawozdanie końcowe będą przechowywane w pomieszczeniach archiwum
Personel
- zna zasady DPL
- ma dostęp do planu badania i SOP (stosuje się do instrukcji, dokumentuje dane łącznie z odstępstwami)
- rejestruje, niezwłocznie i dokładnie,dane źródłowe zgodnie z zasadami DPL
- przestrzega BHP
- zawiadamia o wszystkich czynnikach mających wpływ na wynik badania łącznie ze stanem swojego zdrowia
Dzięki strukturze składającej się z kierownika kontroli, personelu kontrolującego i działu zapewnienia jakości realizowana jest zasada wielu par oczu.
Kierownik kontroli jest odpowiedzialny za przestrzeganie zasad DLP/GLP oraz budżetu.
Personel kontrolujący przeprowadza pierwszą kontrolę jakości zgodnie z planem kontroli.
Personel działu zapewnienia jakości stanowi drugą instancję w ramach kontroli jakości. Do jego zadań należy także ostateczne zatwierdzenie standardowej instrukcji stanowiskowej.
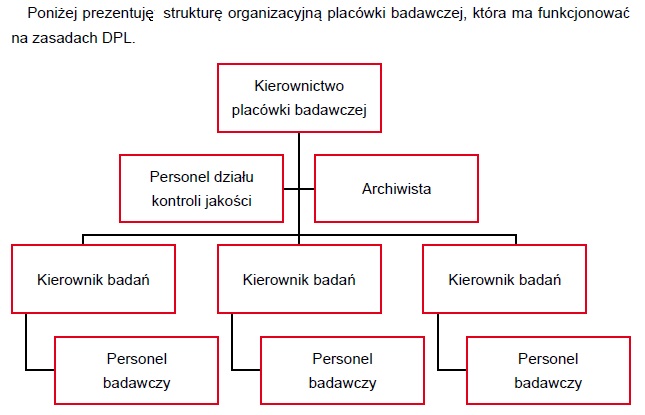
Instrukcje stanowiskowe – SOP / SPO
W przypadku DPL prace są wykonywane wedle standardowych instrukcji stanowiskowych, które muszą być do wglądu na każdym stanowisku pracy.
W tych instrukcjach opisywane są wszelkie czynności, które są istotne dla DPL. Każda placówka badawcza tworzy własne instrukcje stanowiskowe, które muszą być regularnie sprawdzane i aktualizowane.
Dla takiej standardowej instrukcji stanowiskowej (ang. Standard Operating Procedure) stawiane są określone wymogi zgodnie z DPL. Z tego powodu instrukcja stanowiskowa musi być dostępna w aktualnej wersji i w formie pisemnej na każdym stanowisku pracy.
Pod względem treści instrukcja taka musi opisywać i definiować czynności istotne dla DPL.
Instrukcje stanowiskowe muszą być tworzone odrębnie dla każdej placówki badawczej i traktowane poufnie. Istnieją wprawdzie szablony, z których można korzystać, ale muszą być one odpowiednio dostosowane i zatwierdzone przez kierownictwo placówki badawczej.
Załącznik 1, rozdział 1, pkt 9:
standardowa procedura operacyjna–udokumentowana procedura określająca sposób przeprowadzenia badania, a także określającą postępowanie nie opisane dokładnie w planach badania lub w wytycznych do badań;
Pod względem treści instrukcja stanowiskowa musi opisywać i definiować wszystkie czynności istotne pod kątem GLP. Jest ona wiążąca dla personelu i obejmuje następujące obszary:
- Przedmioty badań i przedmioty wzorcowe
- Urządzenia, materiały i odczynniki
- Prowadzenie notatek, sprawozdawczość, przechowywanie i wyszukiwanie
- Systemy kontroli (biologiczne)
- Metody kontroli jakości
- Postępowanie w ramach metod kontroli/analizy
- Systemy wspomagane komputerowo
- Ewentualne „interfejsy” z instytucjami wewnętrznymi i zewnętrznymi
Po utworzeniu standardowej instrukcji stanowiskowej musi zostać ona podpisana przez osobę, która ją utworzyła oraz przez sprawdzającego. Następnie musi ona zostać zaakceptowana przez dział kontroli jakości, a na koniec odebrana przez kierownika placówki badawczej. Dopiero gdy te cztery podpisy figurują na dokumencie, wolno ją oddać pracownikom.
Przykłady Standard Operating Procedures
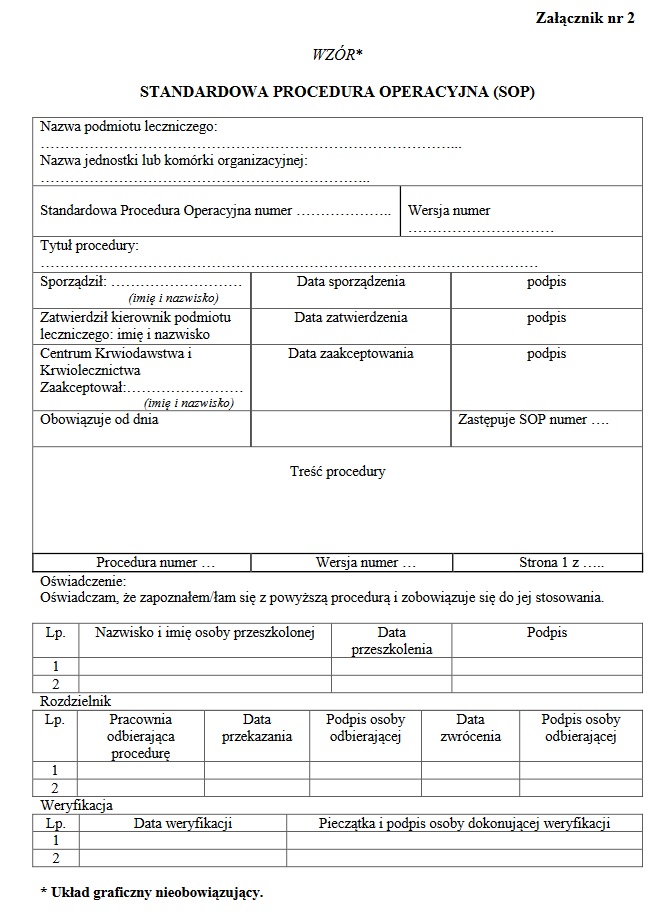
Zapamiętaj: Standard Operating Procedures (SOP) to procedury opisujące wszelkie działania podejmowane w laboratorium.
W celu zapewnienia jakości i prawidłowości wykonywanych badań jednostka badawcza posiada standardowe procedury operacyjne w postaci dokumentu zatwierdzonego przez zarządzającego jednostką badawczą (poprawki są również przez niego zatwierdzane).
Definiują jak korzystać z protokołów badań i często są etapowym (chronologicznym) zapisem następujących po sobie działań związanych z daną czynnością (np.przychód, identyfikacja, oznakowanie, praca z materiałami, pobieranie próbek i przechowywanie)
Są ponadto podstawowym elementem sprawdzanym podczas audytu i zostały utworzone w celu ułatwienia pracy.
Zwracają także uwagę na przetrzymywanie danych i ich odzyskiwanie, w tym raportów.
Definiują tzw. dane surowe i metody analityczne.
Stosowane są także co do inspekcji i użytkowania urządzeń, przyrządów pomiarowych, materiałów pomocniczych, odczynników, systemów komputerowych (stosowanie, czyszczenie, wzorcowanie, walidacja, zabezpieczanie systemów, kontrola i tworzenie kopii zapasowych, oznakowywanie, konserwacja, kalibracja, testowanie, postępowanie w przypadku uszkodzeń).
Odnośnie systemów badawczych (przygotowanie pomieszczeń do badań i odpowiednie warunki środowiskowe, procedury odbioru/transportu/rozmieszczenia/opieki nad systemem i identyfikacji, obserwacje przed i po nie tylko podczas badania, zbieranie i postępowanie z próbkami, a także umiejscowienie systemów badawczych w harmonogramie badania.
Co do programu zapewnienia jakości, sposób postępowania personelu programu zapewnienia jakości podczas planowania, ustalania, przeprowadzania, dokumentowania i sprawozdawania inspekcji.
W odniesieniu do materiału badanego i materiału odniesienia–przychód, identyfikacja, oznakowanie, postępowanie z materiałami, pobieranie próbek i przechowywanie.
Każde odstępstwo musi być udokumentowane, przy jednoczesnym powiadomieniu kierownika, lub głównego wykonawcy.
Program Zapewnienia Jakości
Załącznik 1, rozdział 1, pkt 8:
program zapewnienia jakości–procedury wykonywane przez personel niezależny od przeprowadzanego badania, wprowadzone w jednostce badawczej w celu zapewnienia zarządzającemu jednostką badawczą zgodność i przeprowadzanych badań z zasadami Dobrej Praktyki Laboratoryjnej
Jednostka badawcza musi mieć udokumentowany Program Zapewnienia Jakości, który gwarantuje, że prowadzone badania są zgodne z zasadami Dobrej Praktyki Laboratoryjnej.
- Musi on być prowadzony przez osobę bądź osoby wyznaczone przez zarządzającego jednostką badawczą, a także bezpośrednio przed nim odpowiedzialne.
- Ponadto osoby te muszą być obeznane ze stosowanymi w jednostce badawczej metodami badań, jednakże nie mogą brać udziału w badaniach, których jakość ma być zapewniona. Występowała by tutaj stronniczość czego należy unikać.
- Personel musi posiadać Standardowe Procedury Operacyjne, omówione powyżej.
- Reguluje również przechowywanie kopii wszystkich zatwierdzonych planów badań i stosowanych SOP i znajomość planu działania jednostki.
- Weryfikacja planu badania aby był zgodny z DPL i prowadzenie dokumentacji na ten temat.
- Przeprowadzanie inspekcji, czy SPO są łatwo dostępne dla personelu badawczego i przestrzegane, a także czy podczas pracy stosuje się DPL.
- Zapisy z każdej inspekcji muszą być przechowywane.
- System jakości zakłada weryfikowanie i sprawdzanie końcowego sprawozdania.
- Raporty z inspekcji muszą być niezwłocznie przekazywane zarządzającemu jednostką badawczą, kierownikowi badania, albo głównemu wykonawcy.
- Konieczność przygotowania oświadczenia do końcowego sprawozdania
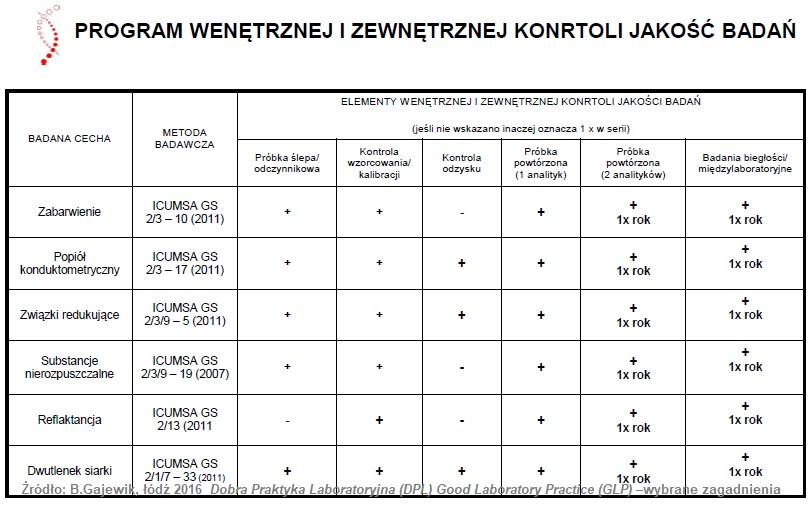
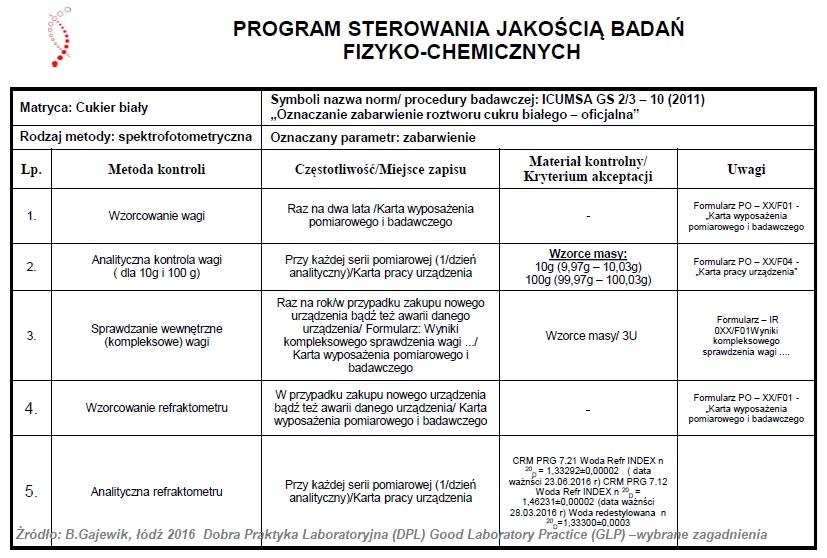
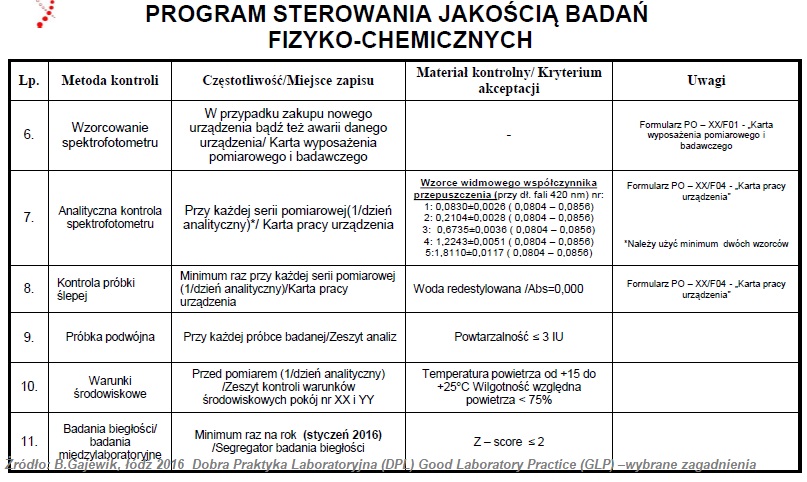
Pomieszczenia jednostki badawczej
Jednostka badawcza, żeby sprostać wymaganiom jakie stawia dobra praktyka laboratoryjna przeprowadzenia badań, oraz ograniczyć do minimum ryzyko negatywnego wpływu na wiarygodność wyników badań powinna być właściwych rozmiarów, spełniać odpowiednie warunki konstrukcyjne, jak i lokalizacyjne.
W celu zagwarantowania właściwego przeprowadzenia każdego badania, pomieszczenia jednostki badawczej powinny być tak zaprojektowanie by zapewnić odpowiedni stopień rozdzielenia i wykonywania różnych czynności.
Ponadto niezwykle istotne jest by istniały oddzielne pomieszczenia przeznaczone na przechowywanie materiałów badanych oraz materiałów odniesienia, jak i na usuwanie odpadów (ponadto posiada procedury zbierania odpadów, ich unieszkodliwiania i transportu) , na archiwum i przyjmowanie na odbiór dostaw.
Archiwa służą do przechowywania planów badań, danych źródłowych, sprawozdań końcowych, próbek oraz materiału badanego i materiału odniesienia.
Aparatura, materiały i odczynniki
Według zasad GLP:
- Wszystkie przyrządy, włączając w to systemy komputerowe muszą posiadać odpowiednie parametry. Ponadto muszą być rozmieszczone w odpowiednich miejscach.
- Wszystkie przyrządy pomiarowe znajdujące się w jednostce badawczej powinny być poddawane zarówno sprawdzeniu, jak i czyszczeniu, konserwowaniu oraz kalibrowaniu (wzorcowanie zgodne z SOP- odnoszone jeśli to do wzorców państwowych lub międzynarodowych i za każdym razem odnotowywane).
- Przyrządy, programy nie powinny one mieć negatywnego wpływu na systemy badawcze.
- Kolejnym istotnym wymogiem jest to, że wszystkie substancje chemiczne, odczynniki oraz roztwory powinny być zaopatrzone w etykiety, które zawierają informacje dotyczące ich tożsamości, okresu ważności oraz szczególnych warunków przechowywania.
- Okres ważności substancji, mieszanin i odczynników chemicznych może być przedłużony wyłącznie po dokonaniu oceny na podstawie dokumentów, bądź analizy.
Systemy badawcze
Zasady Dobrej Praktyki Laboratoryjnej dotyczą również systemów badawczych, zarówno fizykochemicznych, jak i biologicznych.
Wszelkie przyrządy pomiarowe, które stosowane są do uzyskiwania danych o właściwościach fizykochemicznych powinny posiadać odpowiednie parametry funkcjonalne.
W celu zagwarantowania jakości uzyskiwanych danych, należy zagwarantować odpowiednie warunki przetrzymywania, obsługi i opieki nad biologicznymi systemami badawczymi.
Należy również prowadzić zapisy dotyczące pochodzenia, daty otrzymania i stanu w dniu otrzymania.
Nowo sprowadzone zwierzęta oraz rośliny zależy poddać kwarantannie do czasu, gdy nie zostanie oceniony stan ich zdrowia.
W dniu rozpoczęcia doświadczalnej części badania systemy biologiczne powinny być wolne od chorób oraz cech, które mogłyby wpływać na przebieg badania.
Systemy biologiczne, które w przebiegu badania zachorowały bądź zostały okaleczone, powinny zostać odizolowane i odpowiednio leczone.
Na pomieszczeniach, klatkach lub pojemnikach, w których znajdują się systemy biologiczne, są umieszczane wszystkie niezbędne informacje do ich identyfikacji (na przykład pochodzenie,datę otrzymania i stanu biologicznych systemów badawczych w dniu ich otrzymania) .
Pomieszczenia, klatki i pojemniki są czyszczone i odkażane z odpowiednią częstotliwością. Żaden materiał, który w czasie badania pozostaje w kontakcie z systemem biologicznym, nie może posiadać zanieczyszczeń w stężeniach, które mogłyby zakłócić badanie. Podściółka dla zwierząt jest zmieniana z częstotliwością wymaganą w hodowli takich zwierząt, a zastosowanie środków ochrony przed organizmami niepożądanymi powinno być udokumentowane.
Systemy badawcze stosowane w badaniach terenowych są rozmieszczone w sposób minimalizujący możliwość wpływu używanych w przeszłości pestycydów lub wpływu zabiegów z użyciem pestycydów z obszarów sąsiadujących.
Materiały badane i materiały odniesienia
Materiał badany – materiał lub wyrób będący przedmiotem badania
Materiał odniesienia – każdy dobrze opisany materiał, użyty w celach porównawczych
Jednostka badawcza musi prowadzić charakterystykę materiałów, czyli daty otrzymania, okresy ważności, jak również ewidencję ilości materiałów otrzymanych i wykorzystanych w badaniach.
W każdy badaniu materiał badany/odniesienia musi umożliwiać jego zidentyfikowanie, czyli musi być znana tożsamość, numer serii, skład, czystość, stężenie, numer CAS (numer nadany przez Chemical Abstract Service), itp
Należy również wprowadzić procedury pracy z materiałami, pobierania próbek oraz przechowywania, w celu zapewnia jednorodności i stabilności materiału. Wyklucza to możliwość pomieszania lub zanieczyszczenia materiałów. W każdym badaniu podaje się tożsamość materiału, numer serii, jego skład, czystość oraz stężenie lub inne informacje definiujące każdą serię materiału.
Z kolei pojemniki, które służą do przechowywania powinny zostać zaopatrzone w datę ważności, numer partii, informację o składzie, stężeniu, czystości oraz instrukcje dotyczące szczególnych warunków przechowywania.
W przypadku wszystkich badań, oprócz badań krótkoterminowych, są przechowywane próbki każdej serii materiału badanego w celu ich analizy.
Przeprowadzenie badania i zawartość planu badania
Przed rozpoczęciem każdego badania sporządza się w formie pisemnej plan badania, zweryfikowany pod kątem zgodności z zasadami DPL przez personel programu zapewnienia jakości i zatwierdzony podpisem z datą przez kierownika badania i zarządzającego jednostką badawczą.
W przypadku badań krótkoterminowych możliwe jest stosowanie ogólnego planu badania z dołączanym suplementem precyzującym konkretne zadania;
- wszelkie zmiany w planie badania zatwierdza się datowanym podpisem kierownika badania i przechowuje wraz z planem badania;
- wszelkie odstępstwa od planu badania są opisane, wyjaśnione i zatwierdzone w odpowiednim czasie datowanym podpisem przez kierownika badania lub głównego wykonawcę lub wykonawców i przechowywane wraz z danymi źródłowymi.
Trzeba również sporządzić zapisy, które z dokumentów i materiałów zostaną zachowane. Głównie dla celów analizy i dokumentacji.
Plan badania powinien zawierać m.in.:
- Określenie badania, materiału badanego i odniesienia (opisowy tytuł -zdanie określające rodzaj i cel badania, określenie tożsamości badanego materiału za pomocą kodu lub nazwy, określenie materiału odniesienia, który będzie stosowany w badaniu);
- Informacje dotyczące zleceniodawcy i jednostki badawczej (nazwę i adres: zleceniodawcy i jednostki badawczej oraz miejsc badania, nazwisko i adres kierownika badania, nazwisko i adres głównego wykonawcy/wykonawców i etapy badania podlegające głównemu wykonawcy/wykonawcom, delegowane przez kierownika badania);
- Daty (zatwierdzenia planu badania przez kierownika i zarządzającego jednostką badawczą wraz z ich podpisami, proponowane daty rozpoczęcia i zakończenia części eksperymentalnej badania);
- Metody badań (odnośniki do metod określonych w przepisach ustaw lub metod obowiązujących w UE lub wytycznych OECD, dotyczących metod badań substancji chemicznych i ich mieszanin, ewentualnie innych wytycznych i zaleceń metodycznych, w tym obowiązujących norm;
- Trzeba również sporządzić zapisy, które z dokumentów i materiałów zostaną zachowane. Głównie dla celów analizy i dokumentacji.
- Natomiast jeśli mają zastosowanie zawieramy informacje szczegółowe, takie jak:uzasadnienie wyboru systemu badawczego, charakterystykę tego systemu,sposób narażenia wraz z jego uzasadnieniem,poziomy dawkowania, stężeń, okres narażenia, dotyczące badania (np. chronologiczny opis, wszystkie metody badań, materiały, warunki itp)
- Każde badanie przeprowadzane w jednostce badawczej posiada odrębny numer, kod lub nazwę identyfikującą to badanie, tym numerem, kodem lub nazwą są oznaczane wszystkie materiały stosowane w tym badaniu;
- Próbki zbadań są oznakowane w sposób umożliwiający ich identyfikację, w tym odniesienie ich do badania, z którego pochodzą;
- Wszystkie dane uzyskane podczas badania są rejestrowane niezwłocznie i z należytą starannością, dokładnie i czytelnie, podpisane lub parafowane i opatrzone datą przez osobę zbierającą dane;
- Każda zmiana wdanych źródłowych jest dokonywana w sposób umożliwiający odczytanie poprzedniego zapisu, ze wskazaniem powodu dokonania zmiany, podpisana i opatrzona datą przez osobę dokonującą zmiany;
- Dane rejestrowane bezpośrednio przez komputer umożliwiają identyfikację czasu ich wprowadzenia i osobę/osoby odpowiedzialne za ich wprowadzanie;
- Stosowane systemy komputerowe zapewniają pełną kontrolę i przechowywanie procesu przetwarzania danych, pokazując wszystkie zmiany w stosunku do danych źródłowych w sposób umożliwiający ich pełny audyt; a także umożliwiają powiązanie wprowadzonych zmian z osobą dokonującą tych zmian, w szczególności przez stosowanie podpisów elektronicznych opatrzonych datą.
- W przypadku dokonania zmian podaje się powód ich dokonania.
Sprawozdanie z badań
Z każdego badania mamy obowiązek sporządzić sprawozdanie końcowe. W przypadku badań krótkoterminowych dopuszcza się stosowanie standardowego sprawozdania, z dołączanym suplementem precyzującym konkretne zadania.
W przypadku badań wykonywanych w wielu miejscach sprawozdanie końcowe sporządza się na podstawie sprawozdań sporządzonych, podpisanych i opatrzonych datą przez głównych wykonawców lub personel badawczy biorących udział w badaniu.
Sprawozdanie końcowe zawiera w szczególności następujące informacje:
- Identyfikujące badanie, materiał badany i materiał odniesienia (opisowy tytuł. tożsamość materiału lub wyrobu badanego, tożsamość materiału odniesienia, charakterystykę materiału badanego, między innymi nazwa według terminologii IUPAC, numer CAS (numer nadany przez Chemical Abstract Service),parametry biologiczne).
- Daty (rozpoczęcia i zakończenia).
- Oświadczenie osoby/osób prowadzących program zapewnienia jakości, zawierające rodzaje i daty przeprowadzanych inspekcji.
- Opis materiałów i metod badań (w tym odnośniki do metod badań)
- Wyniki badań (streszczenie, informacje wymagane przez plan badania, wyniki badań plus określenie istotności statystycznej, ocenę i omówienie wyników, wnioski, informacje na temat przechowywania planu, materiałów i dokumentów)
- Wymagane dane i informacje jednostki i podmiotu zlecającego badania.
ARCHIWIZACJA I PRZECHOWYWANIE ZAPISÓW I MATERIAŁÓW
Jednostka badawcza przechowuje przez okres co najmniej 10 lat następujące materiały w celu umożliwienia Inspektorowi do Spraw Substancji i Preparatów Chemicznych ich sprawdzenia spełnienia standardów (Dobra Praktyka Laboratoryjna).
- plan badania, dane źródłowe, próbki materiału badanego i referencyjnego, próbki pobrane z systemów badawczych oraz końcowe sprawozdanie z każdego badania;
- raporty wszystkich inspekcji przeprowadzonych przez personel programu zapewnienia jakości oraz plany działania jednostki;
- zapisy dotyczące kwalifikacji, szkolenia i nabytego doświadczenia przez pracowników jednostki badawczej i opis rodzaju wykonywanych przez nich prac;
- zapisy i raporty dotyczące konserwacji i wzorcowania wyposażenia pomiarowego;
- dokumentację sprawdzania skomputeryzowanych systemów;
- kopie wszystkich wydań Standardowych Procedur Operacyjnych;
- dane dotyczące monitorowania środowiska wykonywania badań.
W przypadku konieczności usunięcia próbek materiału badanego i referencyjnego lub próbek pobranych z systemów badawczych przed upływem 10 lat, należy podać i udokumentować przyczynę wcześniejszego ich usunięcia,a w szczególności próbki takie można usunąć, jeżeli ich stan nie pozwala na ich ocenę.
- materiały przechowywane w archiwach powinny być skatalogowane w celu ich łatwego magazynowania i dostępu do tych materiałów;
- dostęp do archiwum mają wyłącznie osoby upoważnione przez zarządzającego jednostką badawczą;
- przychód i rozchód materiałów w archiwum powinien być rejestrowany.
W przypadku, gdy jednostka badawcza lub jednostka w której znajdują się archiwa ulegną likwidacji i nie mają prawnych sukcesorów, archiwa zostaną przekazane do archiwów zleceniodawcy lub zleceniodawców.
Kontrola zgodna z GLP i zezwolenie
§ 4. 3.W ramach kontroli i weryfikacji:
- sprawdza się strukturę zarządzania oraz procedury operacyjne;
- przeprowadza się wywiady z personelem;
- ocenia się integralność danych otrzymanych w jednostce badawczej;
- ocenia się stopień zgodności z zasadami Dobrej Praktyki Laboratoryjnej
Przebieg kontroli:
- Kierownik kontroli akceptuje kontrolę, a następne sporządza plan kontroli.
- Plan kontroli musi być gotowy przed rozpoczęciem pracy, musi on także zostać zatwierdzony i podpisany przez personel działu zapewnienia jakości, kierownika kontroli i zleceniodawcę.
- Plan kontroli obejmuje przebieg kontroli, metody kontroli i częstotliwość przeprowadzania kontroli.
- Możliwe są regularne inspekcje pracowników działu zapewnienia jakości pod kątem przestrzegania zasad GLP.
- Przebieg kontroli jest przeprowadzany eksperymentalnie, przy czym dokumentowane są dane surowe.
- Na podstawie wyników kontroli GLP kierownik kontroli sporządza raport końcowy, który z kolei musi zostać zatwierdzony przez dział zapewnienia jakości.
Przebieg wydawania zezwolenia:
- Wydanie zezwolenia jest możliwe dopiero wówczas, gdy wszystkie dokumenty są kompletne, udokumentowane i zarchiwizowane.
- Zasada dotycząca zezwolenia brzmi: co nie jest udokumentowane, jest automatycznie oceniane jako niewykonane.
- Brak dokumentów może skutkować nieuzyskaniem zezwolenia dla produktu i tym samym prowadzić do znacznych strat czasu i zwiększenia kosztów.
Jak należy prawidłowo przeprowadzać testy w ramach GLP?
W zależności od wymagań w ramach GLP przeprowadza się testy na opracowywanych substancjach aktywnych lub na gotowym leku przeważnie w inkubatorach i komorach klimatycznych.
Walidacja urządzeń
Jest to proces konieczny dla metod analitycznych. Dane uzyskane z „wadliwych” urządzeń mogą budzić różnego typu zastrzeżenia.
Natomiast częstość kalibracji, rewalidacji i testowania zależy od urządzenia oraz stopnia jego wykorzystania w laboratorium. W każdym przypadku, gdy działanie urządzenia nie spełnia kryteriów “control limits” przygotowywany raport musi zostać zamknięty, a badanie przerwane Trzeba pamiętać o braku możliwości usuwania danych z zapisu pracy urządzenia.
Dane aparatury badawczej powinny zawierać:
- Nazwę urządzenia oraz jego wytwórcę
- Model lub typ, co powinno ułatwić identyfikację
- Numer seryjny
- Datę dostarczenia urządzenia do laboratorium
- Instrukcję obsługi dostarczoną przez producenta
Kontrola DPL, na co zwracać uwagę?
Jeśli spodziewasz się kontroli zgodnie z rozporządzeniem DPL dobrze jest się do niej za wczasu przygotować. Możesz również zastosować poniższą wiedzę do ulepszenia funkcjonowania swojego laboratorium.
Inspektorzy DLP przed przystąpieniem do kontroli zapoznają się z:
- planem działania jednostki badawczej
- schematem organizacyjnym jednostki badawczej
- kopiami planów sytuacyjnych pomieszczeń
- stosowanymi SPO / SOP
- danymi osób odpowiedzialnych za program zapewnienia jakości wraz z danymi potwierdzającymi ich kwalifikacje
- danymi personelu badawczego i danymi potwierdzającymi ich kwalifikacje
- protokołami z poprzednich kontroli
- dokumentami informującymi o zakresie badań prowadzonych w jednostce badawczej
Przed przystąpieniem do kontroli i weryfikacji ustala się imię i nazwisko osoby prowadzącej program zapewnienia jakości, która będzie uczestniczyć w kontroli.
Przed przystąpieniem do kontroli i weryfikacji przeprowadza się konferencję otwierającą, podczas której inspektor DPL:
- przedstawia cel, zakres i program kontroli i weryfikacji;
- dokonuje prezentacji uczestników zespołu kontrolującego, zakresu uprawnień i odpowiedzialności
- dokonuje prezentacji sposobu dokonywania kontroli i weryfikacji
- omawia zagadnienia związane z zachowaniem poufności
- wskazuje dokumenty, które będą wymagane do przeprowadzenia kontroli (takie jak wykaz badań zakończonych i badań będących w toku, plany badań, sprawozdania końcowe, standardowe procedury operacyjne, oraz ustala zasady dostępu do otrzymanych dokumentów i ich kopiowania
- omawia strukturę organizacyjną jednostki badawczej
- określa obszar kontroli jednostki badawczej
- zapoznaje się z rodzajami wykonywanych w jednostce badawczej badań spoza zakresu DPL
- określa zapisy i materiały, które są wymagane do przeprowadzenia rewizji badań
- ustala miejsce i termin konferencji zamykającej
- ustala miejsce i terminy zamkniętych posiedzeń inspektorów DPL
W zakresie organizacji jednostki badawczej inspektor DPL sprawdza, czy jednostka badawcza posiada dostateczną liczbę wykwalifikowanego personelu, zapewnia właściwe szkolenia personelu, posiada właściwe pomieszczenia do badań, odpowiednią procedurę monitorowania stanu zdrowia personelu, a także odpowiednie wyposażenie pomiarowe i badawcze oraz materiały niezbędne do terminowego i prawidłowego przeprowadzenia badania.
Zarządzający jednostką badawczą na żądanie inspektora DPL przedstawia:
- schemat organizacyjny jednostki badawczej
- plany sytuacyjne pomieszczeń
- dokument potwierdzający wyznaczenie w jednostce badawczej osoby lub osób prowadzących program zapewnienia jakości
- dokumenty potwierdzające doświadczenie zawodowe personelu
- wykaz lub wykazy badań będących w toku i badań zakończonych, z informacją o rodzaju badań, datach rozpoczęcia lub zakończenia badania, rodzaju systemu badawczego, metodach zastosowanych do oznaczenia materiału badawczego oraz imię i nazwisko kierownika badań
- strategię nadzoru medycznego pracowników
- zapisy każdego pracownika, także personelu technicznego, dotyczące kwalifikacji, szkoleń, zdobytego doświadczenia i rodzaju wykonywanych prac,a także zakres obowiązków oraz programy i zapisy szkoleń personelu
- spis SPO SOP
- wykaz lub wykazy kierowników badań i zleceniodawców
Inspektor DPL sprawdza, czy w jednostce badawczej istnieje stosowany program zapewnienia jakości gwarantujący, że badania są prowadzone zgodnie z zasadami DPL. Odnośnie programu zapewnienia jakości sprawdza:
- kwalifikacje osób prowadzących program zapewnienia jakości
- czy osoba lub osoby prowadzące program zapewnienia jakości nie biorą udziału w badaniach, których jakość monitorują
- w jaki sposób osoba lub osoby prowadzące program zapewnienia jakości tworzą harmonogram inspekcji i przeprowadzają inspekcje oraz w jaki sposób monitorują krytyczne fazy badań, oraz jakie zasoby są dostępne dla przeprowadzanych przez nie inspekcji
- zakres i wnikliwość monitorowania przez osobę lub osoby prowadzące program zapewnienia jakości praktycznej części badania
- zakres i wnikliwość monitorowania przez osobę lub osoby prowadzące program zapewnienia jakości rutynowych działań
- procedurę programu zapewnienia jakości dotyczącą sprawdzenia sprawozdania końcowego w celu potwierdzenia, że wyniki podane w sprawozdaniu odpowiadają danym źródłowym uzyskanym w badaniach
- procedurę przekazywania zarządzającemu jednostką badawczą sprawozdań dotyczących problemów
- podejmowane działania w przypadku stwierdzenia odstępstw
- rolę programu zapewnienia jakości w przypadku, kiedy badania bądź części badań są prowadzone w innym laboratorium
- rolę programu zapewnienia jakości przy przeglądzie, zmianie i uaktualnianiu SOP
W odniesieniu do ogólnych wymagań dla pomieszczeń dla systemów badawczych inspektor DPL sprawdza:
- jednostka badawcza posiada wystarczającą powierzchnię, spełnia odpowiednie warunki konstrukcyjne i lokalizacyjne, tak aby sprostać wymaganiom prowadzenia badań i ograniczyć do minimum ryzyko negatywnego wpływu otoczenia na wiarygodność ich wyników lub wzajemnego wpływu jednego badania na drugie
- jednostka badawcza posiada system kontroli i monitoringu pomieszczeń lub obszarów, w których znajdują się systemy badawcze
- poszczególne pomieszczenia lub obszary są prawidłowo utrzymywane i, jeżeli to konieczne, czy istnieje procedura zwalczania szkodników
W przypadku pomieszczeń dla systemów biologicznych (roślinnych i zwierzęcych):
- zapewnia pomieszczenia odpowiednie dla zapobiegania stresowi zwierząt oraz dla zapobiegania innym problemom mogącym wpływać na jakość otrzymanych danych oraz czy są utrzymywane odpowiednie warunki przetrzymywania, obsługi i opieki nad systemami biologicznymi
- zapewnia właściwe pomieszczenia dla zwierząt i roślin do odbycia kwarantanny, dopóki nie zostanie oceniony ich stan zdrowia, oraz potwierdza, że proces kwarantanny przebiega prawidłowo
- zapewnia odpowiednią liczbę pomieszczeń lub obszarów do izolowania systemów biologicznych, u których istnieje podejrzenie wystąpienia chorób biologicznych
- zapewnia zachowanie zapisów z monitoringu stanu zdrowia, zachowań i innych aspektów
- posiada procedury określające system kontroli i monitoringu pomieszczeń lub obszarów, w których znajdują się systemy biologiczne, i zapewnia, że posiadany system jest odpowiedni, serwisowany i efektywny;
- zapewnia, że pomieszczenia, klatki i pojemniki, w których znajdują się systemy biologiczne, są czyszczone i odkażane z odpowiednią częstotliwością
- posiada system kontroli i monitoringu warunków środowiskowych pomieszczeń lub obszarów, w których znajdują się systemy biologiczne
- zapewnia odpowiednie pomieszczenia do zbierania, gromadzenia i usuwania odpadów oraz procedury ich unieszkodliwiania i transportu, prowadzi gospodarkę odpadami oraz usuwa odpady w sposób zabezpieczający system biologiczny przed zakażeniem, zanieczyszczeniem i uszkodzeniem
- zapewnia odpowiednie pomieszczenia i obszary do przechowywania dostaw i sprzętu, oddzielone od pomieszczeń z systemami biologicznymi, w sposób zabezpieczający ten system przed zakażeniem, zanieczyszczeniem i uszkodzeniem
- zapewnia pomieszczenia do przechowywania paszy i podściółki, odpowiednio zabezpieczone przed działaniem niekorzystnych warunków środowiskowych, zanieczyszczeniem oraz narażeniem na działanie szkodników.
W zakresie przyrządów pomiarowych, materiałów i odczynników:
- przyrządy pomiarowe, łącznie ze zwalidowanymi systemami komputerowymi, stosowane do otrzymywania, gromadzenia i przeglądania danych oraz sterowania istotnymi parametrami środowiska badań, posiadają parametry wystarczające do wykonania badania i są rozmieszczone w odpowiednich miejscach, zgodnie z ich przeznaczeniem
- przyrządy pomiarowe są czyste i sprawne
- przyrządy pomiarowe stosowane do badań są okresowo sprawdzane, czyszczone, konserwowane i wzorcowane, zgodnie ze standardowymi procedurami operacyjnymi, i czy czynności te są każdorazowo odnotowane, a wzorcowanie jest odnoszone, jeżeli to możliwe, do wzorców państwowych lub międzynarodowych. Zapisy te są archiwizowane
- substancje i mieszaniny chemiczne, w tym odczynniki, są odpowiednio oznakowane i przechowywane w odpowiedniej temperaturze, a ich oznakowanie zawiera informacje dotyczące ich producenta, tożsamości (z podaniem stężenia, gdy to istotne), okresu ważności i szczególnych warunków przechowywania
- są dostępne informacje o pochodzeniu, dacie przygotowania i stabilności stosowanych substancji i mieszanin chemicznych, w tym odczynników, a ich okres ważności zostaje przedłużony wyłącznie po dokonaniu oceny na podstawie dokumentów lub przeprowadzonej analizy
- próbki są prawidłowo opisane, z uwzględnieniem rodzaju systemu badawczego, kodu badania, rodzaju próbki i daty jej pobrania
- przyrządy pomiarowe i materiały stosowane w badaniach nie wpływają negatywnie na systemy badawcze.
W zakresie systemów badawczych inspektor DPL sprawdza istnienie SOP.
W zakresie systemów fizykochemicznych inspektor DPL sprawdza w szczególności:
- wyposażenie badawcze czy posiada parametry wystarczające do
wykonania badania i jest odpowiednio rozmieszczone - materiał badany i materiał odniesienia posiadają zgodnie z planem badania oznaczoną stabilność
- w systemach zautomatyzowanych dane uzyskane w postaci wykresów, zapisy z urządzeń rejestrujących lub komputerowe wydruki są udokumentowane jako dane źródłowe i są przechowywane w pomieszczeniu archiwum
W zakresie systemów biologicznych inspektor DPL sprawdza w szczególności:
- użyto systemów biologicznych, takich jak wyszczególniono w planie badania
- na pomieszczeniach, klatkach lub na pojemnikach, w których znajdują się systemy biologiczne, są umieszczone wszystkie informacje niezbędne do identyfikacji tych systemów
- w jednostce badawczej są odpowiednie pomieszczenia i czy są ustalone i utrzymywane odpowiednie warunki utrzymywania, obsługi i opieki
- zapewniono odpowiednie rozdzielenie badań prowadzonych na tym samym gatunku zwierząt lub na tym samym rodzaju systemu biologicznego, ale z zastosowaniem różnych materiałów badawczych
- zapewniono odpowiednie rozdzielenie gatunków zwierząt lub innego rodzaju systemu biologicznego w czasie lub w przestrzeni
- są przestrzegane warunki środowiskowe systemów biologicznych
- w przypadku gdy poszczególne systemy biologiczne będą w trakcie badania wyjmowane z ich pomieszczeń, klatek lub pojemników, systemy takie są, jeżeli to możliwe, odpowiednio oznakowane, w celu ich identyfikacji
- są przestrzegane procedury gwarantujące, że żaden materiał, który w czasie badania pozostaje w kontakcie z systemem biologicznym, nie posiada zanieczyszczeń w stężeniach, które mogłyby zakłócić badanie; podściółka dla zwierząt jest zmieniana z częstotliwością wymaganą w hodowli takich zwierząt, a zastosowanie środków ochrony przed organizmami niepożądanymi jest udokumentowane
- istnieją udokumentowane dane dotyczące badania zwierząt i roślin, kwarantanny, zachowania zwierząt, chorób lub padnięć, diagnostyki zwierząt i roślin oraz postępowania właściwego dla danego systemu biologicznego
- istnieją procedury dotyczące właściwego usuwania systemów biologicznych po zakończeniu badania
W zakresie materiałów badanych i materiałów odniesienia inspektor DPL sprawdza:
- materiał badany i materiał odniesienia są właściwie scharakteryzowane
- są prowadzone zapisy dotyczące charakterystyki materiału badanego i materiału odniesienia, dat ich otrzymania i okresu ważności oraz ewidencja ilości materiałów otrzymanych i wykorzystywanych w badaniach
- zostały wprowadzone procedury pracy z materiałami oraz pobierania próbek i ich przechowywania, zapewniające zachowanie jednorodności i stabilności materiału oraz wykluczające możliwość zanieczyszczenia i pomieszania materiałów
- pojemniki zawierające materiały badane i materiały odniesienia są zaopatrzone w dane identyfikujące materiał, datę ważności i instrukcje dotyczące szczególnych warunków przechowywania
- każdy materiał badany i materiał odniesienia jest odpowiednio oznakowany, z zastosowaniem w szczególności: kodu lub nazwy, numeru CAS, parametrów biologicznych
- w celu właściwej identyfikacji każdego materiału badanego lub materiału odniesienia, w każdym badaniu jest znana tożsamość materiału, numer partii, jego skład, czystość oraz stężenie lub czy istnieją inne informacje definiujące każdą serię materiału
- został ustanowiony we współpracy ze zleceniodawcą mechanizm weryfikacji tożsamości materiału badanego – w przypadku gdy materiał badany jest dostarczany przez zleceniodawcę
- jest znana stabilność materiałów badanych i materiałów odniesienia w stosowanych warunkach ich przechowywania oraz badania
- w przypadku gdy materiał badany lub materiał odniesienia są podawane z nośnikiem, określono stopień jego jednorodności, stężenie i stabilność
- z każdej partii materiałów badanych i materiałów odniesienia są pobierane próbki do celów analitycznych i czy są one przechowywane przez właściwy okres – jeżeli badanie trwa dłużej niż cztery tygodnie
- w przypadku wszystkich badań, oprócz badań krótkoterminowych, są przechowywane próbki każdej partii materiału badanego w celu ich ewentualnej analizy
- istnieją procedury mieszania materiałów badanych w celu uniknięcia pomyłek i wzajemnego zanieczyszczenia
W zakresie SOP – SPO inspektor DPL sprawdza:
- jednostka badawcza posiada SOP, w postaci dokumentu zatwierdzonego przez zarządzającego jednostką badawczą
- istnieją procedury dotyczące sposobu dokonywania zmian i uaktualniania
- poprawki wnoszone do SOP są udokumentowane i zatwierdzane przez zarządzającego jednostką badawczą
- istnieje procedura przechowywania w pomieszczeniach archiwum nieaktualnych wersji
- każda oddzielna jednostka lub oddzielny obszar w ramach jednostki badawczej otrzymuje SOP związane z prowadzoną działalnością
- każde odstępstwo od SOP w prowadzonych badaniach jest udokumentowane i przedstawiane kierownikowi badania lub głównemu wykonawcy lub wykonawcom
- SOP muszą obowiązkowo istnieć w stosunku do:

W zakresie przeprowadzenia badania inspektor DPL sprawdza:
- zaplanowano i przeprowadzono badanie zgodnie z zasadami DPL
- istnieje plan badania w postaci dokumentu
- wszelkie zmiany w planie badania są podpisywane i opatrywane datą przez kierownika badania i są przechowywane wraz z planem badania
- umieszczono w planie badania, jeżeli to konieczne, datę jego akceptacji przez zleceniodawcę
- wszelkie odstępstwa od planu badania są opisane, wyjaśnione i w odpowiednim czasie podpisane i opatrzone datą przez kierownika badania lub głównego wykonawcę lub wykonawców i przechowywane wraz z danymi źródłowymi
- badanie jest umieszczone w planie działania jednostki badawczej
- badanie jest prowadzone zgodnie z planem badania i SOP
- próbki z badań są oznaczone w sposób umożliwiający ich identyfikację, w tym odniesienie do badania, z którego pochodzą
- wszystkie dane uzyskane podczas badania są rejestrowane bezpośrednio, niezwłocznie, dokładnie i czytelnie, podpisane i opatrzone datą przez osobę zbierającą dane
- każda zmiana danych źródłowych jest dokonywana w sposób umożliwiający odczytanie poprzedniego zapisu, ze wskazaniem powodu dokonania zmiany + podpis i data
- dane uzyskiwane z bezpośrednim wprowadzeniem do pamięci komputera umożliwiają identyfikację czasu ich wprowadzenia i identyfikację osoby odpowiedzialnej za ich wprowadzanie
- istnieją odpowiednie procedury opisujące sposób ochrony danych
- stosowane systemy komputerowe zapewniają pełną kontrolę i przechowywanie procesu przetwarzania danych
- każde nieprzewidziane zdarzenie zapisane w danych źródłowych było sprawdzone i ocenione pod kątem wpływu na wiarygodność prowadzonego badania
- wyniki przedstawione w sprawozdaniu końcowym są kompletne i prawidłowo odzwierciedlają dane źródłowe
W zakresie sprawozdania końcowego inspektor DPL sprawdza:
- czy dla każdego badania zostało sporządzone sprawozdanie końcowe lub – w przypadku badań krótkoterminowych – standardowe sprawozdanie z dołączonym suplementem precyzującym konkretne zadania
- sprawozdanie końcowe zostało podpisane i opatrzone datą przez kierownika badania, który odpowiada za wiarygodność danych i potwierdza, że badanie zostało przeprowadzone zgodnie z zasadami DPL
- sprawozdania sporządzone przez głównych wykonawców lub personel badawczy biorący udział w badaniu są przez nich podpisane i opatrzone datą
- korekty sprawozdania końcowego dokonane po jego podpisaniu przez kierownika badania wprowadzono w formie aneksu, z wyraźnym określeniem powodu dokonania korekt
- sprawozdanie końcowe zawiera oświadczenie osoby lub osób prowadzących program zapewnienia jakości, zawierające rodzaje i daty przeprowadzanych inspekcji (również inspekcje etapów)
- sprawozdanie końcowe wskazuje miejsca przechowywania planu badania, próbek materiału badanego i materiału odniesienia, próbek pobranych z systemów badawczych, danych źródłowych i sprawozdania końcowego
W zakresie archiwizacji i przechowywania danych inspektor DPL sprawdza:
- jednostka badawcza zapewnia pomieszczenie na archiwum, przeznaczone do przechowywania planów badań, danych źródłowych, sprawozdań końcowych, próbek oraz materiału badanego i materiału odniesienia, umożliwiające ich odszukanie
- istnieją odpowiednie procedury określające bezpieczne przechowywanie w pomieszczeniu archiwum zapisów i materiałów
- wyznaczono osobę odpowiedzialną za przechowywanie w pomieszczeniu archiwum
- pomieszczenie archiwum jest odpowiednio dostosowane do przechowywania planów badań, danych źródłowych, próbek materiału badanego i odniesienia, próbek pobranych z systemów badawczych, sprawozdań końcowych z każdego
badania oraz zapisów dotyczących kwalifikacji, szkolenia i nabytego doświadczenia przez pracowników jednostki badawczej - istnieją procedury opisujące sposób wyszukiwania zapisów i materiałów przechowywanych w pomieszczeniu archiwum
- istnieją procedury opisujące dostęp do pomieszczenia archiwum ograniczające ten dostęp wyłącznie do osób upoważnionych oraz procedury przechowywania zapisów personelu uprawnionego do dostępu do materiałów
- istnieją procedury opisujące przychód i rozchód materiałów przechowywanych w pomieszczeniu archiwum
W zakresie rewizji badań inspektor Dobrej Praktyki Laboratoryjnej dokonuje oceny możliwości odtworzenia przebiegu badania, przez porównanie sprawozdania końcowego z planem badania i danymi źródłowymi oraz przez ocenę odpowiednich standardowych procedur operacyjnych, w szczególności:
- uzyskuje informacje dotyczące danych osobowych
- sprawdza, czy jednostka badawcza posiada wystarczającą liczbę personelu badawczego o kwalifikacjach odpowiednich do przeprowadzenia badania
- uzyskuje odpowiednie opisy miejsc pracy, informacje dotyczące kwalifikacji, szkolenia i nabytego doświadczenia przez kierownika i personel
- identyfikuje wyposażenie pomiarowe i badawcze wykorzystane do przeprowadzenia badania i sprawdza zapisy i raporty z ich konserwacji i wzorcowania
- sprawdza zapisy dotyczące analizy stabilności materiału badanego
- ustala, przez prowadzenie wywiadu z kierownikiem badania i personelem badawczym, zakres prac wykonywanych przez poszczególne osoby, tak aby upewnić się, czy osoby dysponowały czasem do wykonania zadań
- uzyskuje kopie dokumentów dotyczących badania (obowiązkowo: planu badania, wykorzystanych SOP, dziennik pracy wyposażenia pomiarowego i badawczego. dzienników laboratoryjnych, plików i wydruków, sprawozdania końcowego, w przypadku badania prowadzonego na zwierzętach, zapisów dotyczących losów określonego odsetka liczby zwierząt od momentu przyjęcia do jednostki badawczej do momentu zakończenia części eksperymentalnej badania;
zapisy te obejmują w szczególności: wagę ciała zwierzęcia, spożycie wody i paszy, sposób podania materiału badanego, obserwację kliniczną, wynik sekcji zwłok, wynik badania biochemicznego i wynik oceny patologicznej)
Po zakończeniu kontroli i weryfikacji prowadzi się konferencję zamykającą podczas której inspektor DPL:
przedstawia sposób postępowania po otrzymaniu protokołu z przeprowadzonej kontroli i weryfikacji
omawia odnotowane odstępstwa
przedstawia sposób postępowania w przypadku braku realizacji zaleceń pokontrolnych
jeżeli to konieczne, informuje o konieczności przeprowadzenia kontroli sprawdzającej, czy odstępstwa od spełniania zasad DPL zostały usunięte
Najważniejsze dokumenty regulujące stosowanie zasad Dobrej Praktyki Laboratoryjnej DPL:
Dyrektywa dotycząca tego czym jest Dobra Praktyka Laboratoryjna do postępu technicznego, która określała harmonizację przepisów ustawowych, wykonawczych i administracyjnych odnoszących się do zasad GLP i weryfikacji ich stosowania na potrzeby badań materiałów chemicznych (1999/11/WE 8.03.1999);
Dyrektywa dotycząca wspólnotowego kodeksu odnoszącego się do produktów leczniczych stosowanych u ludzi (2001/83/WE 6.11.2001);
Dyrektywa 2004/9/WE Parlamentu Europejskiego i Rady z dnia 11 lutego 2004 r. w sprawie kontroli i weryfikacji dobrej praktyki laboratoryjnej (DPL) (wersja skodyfikowana) (Dz.U. L 50 z 20.2.2004, s. 28–43)
Rozporządzenie (WE) nr 1907/2006 Parlamentu Europejskiego i Rady z dnia 18 grudnia 2006 r. w sprawie rejestracji, oceny, udzielania zezwoleń i stosowanych ograniczeń w zakresie chemikaliów (REACH), utworzenia Europejskiej Agencji Chemikaliów, zmieniające dyrektywę 1999/45/WE oraz uchylające rozporządzenie Rady (EWG) nr 793/93 i rozporządzenie Komisji (WE) nr 1488/94, jak również dyrektywę Rady 76/769/EWG i dyrektywy Komisji 91/155/EWG, 93/67/EWG, 93/105/WE i 2000/21/WE (Dz.U. L 396 z 30.12.2006, s. 1–849) Tekst opublikowany ponownie w sprostowaniu (Dz.U. L 136 z 29.5.2007, s. 3–280)
Rozporządzenie Ministra Zdrowia z dnia 4 czerwca 2003 r. w sprawie kryteriów,które powinny spełniać jednostki organizacyjne wykonujące badania substancji i preparatów chemicznych, oraz kontroli spełnienia tych kryteriów ((Dz. U. Nr 116, poz.1103) uchylone 25.02.2010 r.) –wprowadziło w Polsce GLP
Rozporządzenie Ministra Zdrowia z dnia 22 maja 2013 r. w sprawie Dobrej Praktyki Laboratoryjnej i wykonywania badań zgodnie z zasadami Dobrej Praktyki Laboratoryjnej (Dz. U. 2013 Nr 0, poz. 665 )


Rozporządzenie w sprawie wysokości i sposobu wnoszenia opłat przez jednostki badawcze za kontrolę i weryfikację spełniania zasad Dobrej Praktyki Laboratoryjnej
Dobra praktyka laboratoryjna (GLP) (DPL) Przeprowadzanie badań zgodnie z zasadami dobrej praktyki
Czy masz u siebie wdrożone metody przestrzegania praktyki laboratoryjnej i weryfikacja jej stosowania (good laboaratory practice).
A czy Ty stosujesz te zasady u siebie w laboratorium, lub uważasz je za niezbędne?
Napisz w komentarzu poniżej:


Co myślisz o moim nowym wpisie na blogu?
A może masz pytanie dotyczące strategii lub techniki jak działać najlepiej?
Tak czy inaczej, chciałbym usłyszeć, co masz do powiedzenia.
Więc śmiało, teraz udostępnij ten wpis na swoich social mediach i zobacz co inni mają do powiedzenia.



![Podejście procesowe w zarządzaniu. Główny element Systemu Zarządzania [przedsiębiorstwo i organizacja] 25 podejście procesowe](https://www.rafalszrajnert.pl/wp-content/uploads/2020/02/PODEJSCIE-PROCESOWE-960x750.jpg)

